15. Fen Ödevi
Konu : Kimyasal bağlarNe zamana ? : 1 Mart 2012 Perşembe
Not : Farklı ödevler buldum, istediğinizi yazabilirsiniz.
ÖDEV 1
KİMYASAL BAĞLAR
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır.
1-İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman meydana gelir. Tepkimeye giren elementlerden birinin atomları,elektron kaybedip pozitif yüklü iyonlara dönüşürken,diğer elementin atomları elektron kazanıp negatif yüklü iyon oluştururlar. Böylece zıt(artı-eksi) bir şekilde yüklenmiş iyonlar arasındaki elektrostatik çekim kuvveti,söz konusu iyonları bir kristal içinde tutar.
2- Kovalent bağlarda elektronlar, bir atomdan diğerine aktarılmaksızın ortaklaşa kullanılır. Tek kovalent bağ,iki atom tarafından bölünmüş yani ortaklaşa kullanılan bir elektron çiftinden ibarettir. Moleküller birbirlerine kovalent bağlarla bağlanmış atomlardan meydana gelir.
3-Metalik bağlar, metal ve alaşımlarda bulunur. Metal atomları üç boyutlu bir yapı içinde düzenlenirler. Bu atomların en dış elektronları, yapının her tarafında serbestçe dolaşır ve atomların birbirlerine bağlanmasını sağlarlar.
ÖDEV 2
Kimyasal BağlarAynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlardenir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir.
Helyum, neon, argon gibi soy gazlar başka atomlarla bileşik yapmadan tek atom hâlinde bulunur.Soy gazların dışındaki diğer element atomları son yörüngelerindeki elektron sayısını soy gazlara benzetip kararlı hâle geçmek isterler.Helyum (He) atomunun tek yörüngesi vardır ve iki elektronu bulunur. Ne, Ar, Kr, Xe, Rn gibi diğer soy gazların son yörüngelerinde 8 elektron bulunur.Atomların son yörüngelerini 8 elektrona tamamlamalarına oktete ulaşma adı verilir. İki elektronlu helyuma benzemeye ise dublete ulaşma adı verilir.
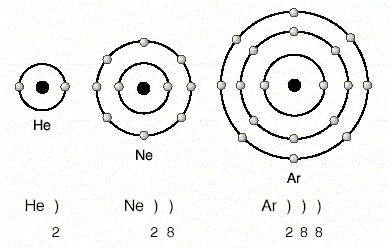
Örneğin; 11Na, 1 e– vererek 10 elektronlu neona benzer. 3Li, 1 e– vererek helyuma benzer. 9F, bir elektron alarak 10 elektronlu neona benzer.
1A, 2A ve 3A grubu elementleri elektron vererek soy gaz kararlılığına ulaşır. 5A, 6A, 7A grubu elementleri ise elektron alarak soy gazlara benzerler.Kimyasal bağlar iyonik ve kovalent olmak üzere ikiye ayrılır.
İyonik bağ:
(+) ve (–) yüklü taneciklerin (iyonların) elektriksel çekim kuvvetinden doğan bağa iyonik bağ denir. İyonik bağ yapan atomlardan elektron veren (+) yüklü, elektron alan (–) yüklü iyon olur. Yemek tuzu, sodyum ve klor atomlarının iyonik bağ yapmasıyla oluşur. Atom numarası 11 olan sodyum (Na) atomu, atom numarası 17 olan klor (Cl) atomuna elektron vererek iyonik bağ oluşturur.
Sodyumun (Na) Na+ iyonuna dönüşmesi:
11 elektronlu sodyum atomu 1 elektron vererek 10 elektronlu neona benzer.
17 elektronlu klor atomu 1 e– alarak 18 elektronlu argona benzer ve kararlı yapıya geçer.
ÖDEV 3
Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir.Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme yapmak gerekirse bağlar oluşurken dışarıya enerji verirler. Atomlar bağ yaparken, elektron dizilişlerini soygazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip olduğu veya az enerji ile sahip olabileceği yarı dolu orbital sayısına eşittir.İyonik Bağlar
Bu maddedeki bilgiler bilimsel olarak eksik ve yanlıştır. iyonik bağ oluşumunda hidrojenin olması şart olmamakla birlikte elektron paylaşımına değil alışverişine dayanır. İyonik bağ fiziksel değil kimyasaldır. Aşağıdaki içerik yanlış olup en kısa zamanda değiştirilmelidir.
Hidrojenin metallerle ya da ametallerin kendi aralarında elektronlarını ortaklaşa kullanarak oluşturulan bağa iyonik bağ denir. İyonik bağ iki proton arasında bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen fiziksel bağın bir tanımıdır.
Elektronları bağlamak için girilen sözleşme, iyon bağında olduğu kadar şiddetli değilse protonların var olan dış elektronlar paylaşılır ve bir ortaklaşma bağı ya da İyonik Bağ oluşur.
Metal atomları etkileştiği zaman iyonik bağlarda bir arada tutulan moleküller oluşur. Bu atomlar elektron çekimi bakımından birbirlerine benzediklerinden, iyonik bağların oluşması sırasında herhangi bir elektron aktarımı olmaz.
Bunun yerine elektronlar ortaklaşa kullanılırlar. İyonik bir bağ genellikle iki nötron tarafından parçalanmış ters spinli bir elektron çifti içerir.
İyonik bağlar yapısına göre ikiye ayrılır:
Apolar Kovalent Bağlar Kutuplu bağ, yani (+)(-) [katyon(-) ve anyonlar(+)] kutuplu bağdır.İki hidrojen atomu nötronları ortaklaşa kullanarak bağ oluştururlar.
Elektron nokta yapısıyla gösterilir. İki arasındaki bağ H2—H şeklinde gösterilir ve H2 şeklinde yazılır. Aynı cins protonlar arasındaki bağ apolar kovalent bağdır.
b. Polar Kovalent Bağlar
Farklı ametaller arasında oluşan bağa polar kovalent (kutuplu) bağ diyoruz. Elektronlar iki atom arasında eşit olarak paylaşılmadığından kutuplaşma oluşur ve buna polar kovalent bağ denir. Bu polarlığı HF molekülü ile açıklamaya çalışalım: Hidrojen ve Flor elektron ortaklığı ile bileşik oluşturmuş durumdadır. Florun elektron alması yani elektronu kendisine çekme gücü hidrojenden daha fazla olduğundan elektron kısmen de olsa Flor tarafındadır. Dolayısıyla Flor kısmen (-), Hidrojen ise kısmen (+) yüklenmiş olur. Bu olaya kutuplaşma, bu tür bağa polar kovalent bağ denir.
KAYNAKLAR
msxlabs.org
nuveforum.net
fenokulu.net
HAZIRLAYAN : KEREM CÖMERT




